Topics
2020.09.30 circular No.15
5ツールプレイヤー:ピロリジニウム塩の魅力上智大学 理工学部物質生命理工学科
藤田 正博
ピロリジニウム塩が好きだ。とても。現在、研究室のほとんどの研究テーマでピロリジニウム塩を使用している。ピロリジニウム塩の魅力について語る前に、表題の5ツールプレイヤーについて簡単に触れておく。野球好きの方に解説は不要であるが、これは走攻守のすべてに優れた選手を表現する野球用語である。メジャーリーグでも大活躍したイチローを思い浮かべてもらうのが手っ取り早いだろうか。日本のプロ野球でいえば、西武ライオンズで大活躍した秋山幸二あたりが、パッと思いつく(年齢がばれる)。このまま野球談義を続けたいが、ここは我慢。5ツールプレイヤーとは、つまり、ミート力、長打力、走塁・盗塁、守備力、送球能力の5つを高いレベルで満たしている選手のことである。それが、なぜピロリジニウム塩にあてはまるのか。思いつきで書いているため、ここからは苦しい弁明が続く。ピロリジニウムカチオンは、多くのアニオン種とイオン液体を形成する(ミート力)。原料であるピロリジンはとてつもなく臭い(長打力)。柔粘性結晶など、イオン液体以外の研究テーマでも頻繁に使用されている(走塁・盗塁)。熱的、電気化学的安定性に優れる。さらに、他のオニウムカチオンに比較してアルカリ耐性が高い(守備力)。いくつかのピロリジニウム塩は、色々な研究者にくり返し使われて、どんどん派生している(送球能力)。こうして5ツールを眺めてみると、ピロリジニウム塩である必然性が、むしろ、ぼやけたような気がする。例えば、ホスホニウム塩(原料のアルキルホスフィンはピロリジンに負けず劣らず臭い)も当てはまるだろうし、もっと言えば、単にイオン液体の特徴をまとめただけのような気もする。自問自答。さて、本稿では本研究室の研究トピックス(図1)を中心にピロリジニウム塩の魅力を紹介させていただく。
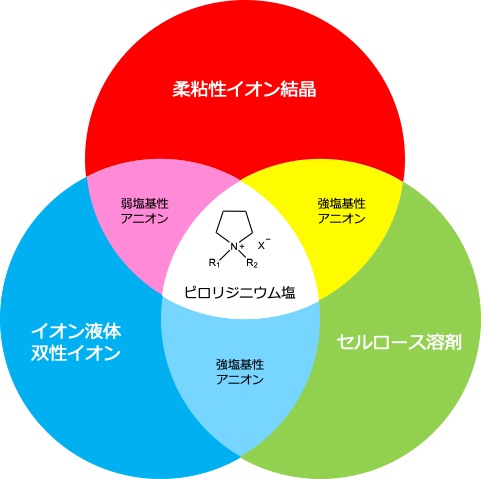
図1. ピロリジニウム塩に関する本研究室の研究トピックス
電気化学の分野で広く使われているイオン液体の一つがピロリジニウム塩である1, 2。ピロリジニウム系イオン液体の例を図2に示す。ピロリジニウム塩の守備力の高さは、電解質材料として魅力的である。さらに、ピロリジニウム塩を電解液に用いた蓄電デバイスの充放電が可能であることもすでに報告されている。例えば、電解液に[C3mpyr][FSA]を用いたLi/LiCoO2セル3やgraphite/Liセル4, 5の充放電が実証されている。電解質材料としてのピロリジニウム塩の潜在能力の高さを疑う余地はない。しかし、ピロリジニウム塩の粘度はイミダゾリウム塩よりも高く、それゆえイオン伝導度は低くなる傾向がある。ピロリジニウムカチオンは脂環式であり、電荷が局在化していることが一因と考えられる。ピロリジニウムカチオンの長所を残したまま、粘性およびイオン伝導性を改善する方法論として、側鎖へのエーテル結合の導入に着目した6。イオン液体の諸特性に及ぼすエーテル結合の効果は、Matsumotoらによって詳細に検討されている。側鎖へのエーテル結合の導入は、ピロリジニウム塩だけでなく6、アンモニウム塩の融点および粘性の低下やイオン伝導度の向上に効果的であることも報告されている7, 8。ただし、側鎖にエーテル結合を導入さえすれば、上記の効果が必ず得られるというわけでもない。側鎖にメトキシエチル基を導入した[C1O2mpyr][FSA] は、[C3mpyr][FSA]よりも高い融点と低いイオン伝導度を示した9, 10。側鎖長の伸長による移動度の低下が一因と考えられる。そこで、側鎖にメトキシメチル基を導入した[C1O1mpyr][FSA] を合成し、諸特性を評価した11。[C3mpyr][FSA]と[C1O1mpyr][FSA]の融点は、それぞれ-912と-32℃であり、メトキシメチル基の導入により融点が約20℃低下した。図3に[C3mpyr][FSA]、[C1O1mpyr][FSA]およびそれらLiTFSA(0.32 mol kg-1)複合体のイオン伝導度のアレニウスプロットを示す11。両イオン液体のイオン伝導度は、0〜100℃の温度範囲において同等であった。一方、0℃より低い温度範囲において、[C1O1mpyr][FSA]の方が高い値を示した。メトキシメチル基の導入により融点が低下したためである。目論見通り、[C1O1mpyr][FSA] は[C3mpyr][FSA]よりも低い融点と高いイオン伝導度を示した。[C1O1mpyr][FSA]/LiTFSAのイオン伝導度は、測定温度範囲内において[C3mpyr][FSA]/LiTFSAよりも高かった。一般的に、Li塩の添加により系の粘性が増加し、イオン伝導度は低下する。メトキシメチル基を導入したことで、Li塩複合体のイオン伝導度低下を抑制することもできた。電解質材料として望ましい性質である。
イオン液体の化学構造はそのままに、電解液としての性質を向上させる方法論として、添加剤に着目した。有機電解液において、添加剤の活用は常套手段の一つであるものの、イオン液体電解質において市民権を得ているとは言い難い。添加剤の種類や添加量によっては、イオン液体の特徴を損なう恐れがあることが一因ではないかと推察される。これまで、双性イオンを添加剤として検討してきた。双性イオンは、カチオンとアニオンを共有結合で結んだ分子内塩である(図4)13, 14。イオン交換が起こらないことを除いて、イオン液体と似た性質をもつ化合物群である(と思っていた)。双性イオンを添加剤として活用できれば、イオン液体の特徴を損なうことなく、電解液としての性質を向上させられるものと期待される。ただし、これは優等生的な発言で、実際は添加剤としてしか活路を見出せなかったというのが本音である。まず、双性イオンの多くは、融点が100℃以上である15。双性イオンの低融点化に関しても、エーテル結合の導入が効果的であった。(余談ではあるが、筆者がB4で大野研に配属された当時、研究室ではPEO/塩ハイブリッド16を用いた電解質材料の開発が全盛の時代であった。ポリエーテルの末端にアニオンまたはカチオンを共有結合で固定し、Li塩に限らず何塩であっても室温で液状化するという化合物である。したがって、エーテル結合を活用すれば、液体の双性イオンが得られるということは、我々にとって自明の理であったわけである。)側鎖へのエーテル結合の導入により室温での双性イオンの液体化には成功し、この点は解決できたものの17, 18、液体化双性イオン自身の低粘性化は断念せざるを得なかった。そこで、オリゴエーテルやイオン液体を添加することにした。双性イオンの最適な濃度を検討した結果、オリゴエーテルやイオン液体に少量の双性イオンを添加するという現在のスタイルに辿り着いたわけである。オリゴエーテル系電解液に双性イオンを添加したところ、酸化電位は5.0 V vs. Li/Li+以上となり、オリゴエーテルの耐酸化性が向上した。電位窓拡張効果の詳細なメカニズムは未解明であるが、双性イオンが電極近傍においてオリゴエーテルの酸化分解を抑制したものと推察される。守備力の優れた電解質材料は、実デバイスの高性能化に貢献できる。実際、電解液にオリゴエーテルを用いたLi/LiCoO2セルの充放電試験を行った結果、双性イオンを添加した系は、高電位において、未添加系よりも高い放電容量とクーロン効率を維持した19, 20。蓄電池の高容量化につながる知見である。充放電容量維持効果は、電解液にイオン液体を用いたLi/LiCoO2セルの充放電試験においても観測された。守備力の高い組み合わせが良いであろうと考え(野球においても、守備が安定している選手ほど監督も使いやすい。筆者は何者?)、ピロリジニウム系イオン液体にピロリジニウム系双性イオン(図2)を添加した21, 22。しかし、ここで紹介した電位窓拡張効果や充放電容量維持効果は、イミダゾリウム系双性イオンでも観測されたため、オニウムカチオンには依存しないこと、双性イオンの構造そのものが重要であることがわかった。かくして、双性イオンは添加剤としての立ち位置を確立するにいたった。
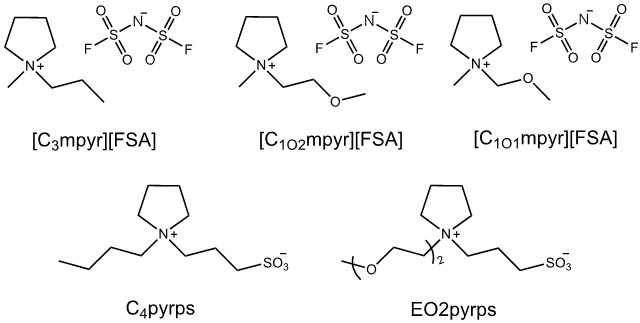
図2. ピロリジニウム系イオン液体および双性イオンの例
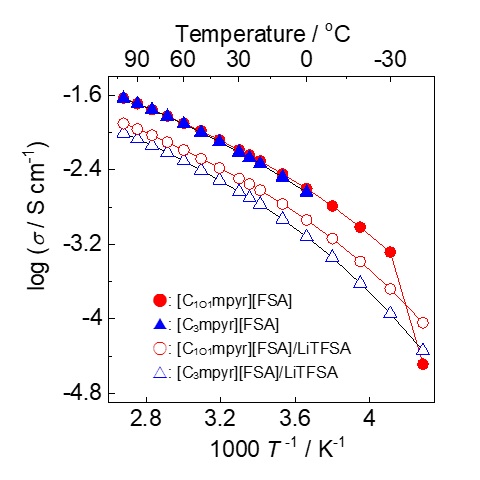
図3. ピロリジニウム系イオン液体のイオン伝導度のアレニウスプロット
図4. 双性イオンの模式図
固液中間相といえば、液晶を思い浮かべる方が大半であろう。実は、固液中間相にはもう一つある。それが柔粘性結晶である。液晶は表示素子として不可欠な材料であり、テレビをはじめとしたデバイスへの実装も進んでいる。スマホ、テレビ、街頭ディスプレイなど、もはや液晶無しの生活など考えられない状況である。一方、社会一般での柔粘性結晶の認知度はといえば、液晶と比較して3周遅れぐらいの気分である(幸い、イオン液体研究会での柔粘性結晶の認知度は液晶と遜色ない、と思っている)。そのような柔粘性結晶にも社会実装のチャンスが巡ってきている。Liイオン二次電池の電解質としての可能性が見出されたためである。1999年、[C2mpyr][TFSA]が柔粘性結晶相を示し、Liイオン伝導体として機能することが、MacFarlaneらによって報告された23。この報告を契機として、柔粘性イオン結晶は新奇固体電解質として注目され始めた。(余談第二弾。1986年には、アンモニウム塩からなる柔粘性イオン結晶がLiイオン伝導体として機能することがAngellらによって報告されている24。時代を先取りし過ぎたのかもしれない。筆者も、かくありたい。)その後、様々な構造の柔粘性イオン結晶が報告されている25, 26。後発組として、何か面白い柔粘性イオン結晶を提案できないかと思案していたある日、ピロリジニウムカチオンとFSAアニオンの組み合わせが、ふと頭をよぎった。ピロリジニウムカチオン、特に[C2mpyr]カチオンは種々のアニオンと柔粘性結晶を形成すること、FSAアニオンは電解質材料として優れていることが知られていたため、これらを組み合わせたらどうなるかという単純な発想である。単純であるがゆえに、すでに先行例があるだろうと思い調べたところ、見つからない。誰かしら試していても良さそうだとノンビリしていた気持ちが、誰かしら試している最中ではと焦り始め、早速[C2mpyr][FSA]を合成した(図5)27。[C2mpyr][FSA]は室温でネチネチの柔らかい白色固体として得られた(図6)。扱いにくいこと、この上ない。さて、[C2mpyr][FSA]の固相間転移温度は-70と-22℃であり、融点は205℃であった。融解エントロピー変化は11 J K-1 mol-1であり、柔粘性結晶の指標となるTimmermansの経験則(< 20 J K-1 mol-1)を満たしている28。[C2mpyr][FSA]は-22から205℃という電解質材料としては理想的な温度範囲において、柔粘性結晶相を示すことがわかった。化学構造が類似している[C2mpyr][TFSA]の融点は109℃である。予想に反して、[C2mpyr][FSA]の融点は約100℃上昇した。さらに、25℃における[C2mpyr][FSA]のイオン伝導度は1.23×10-6 S cm-1であり、[C2mpyr][TFSA](1.45×10-8 S cm-1)よりも100倍高い値であった。[C2mpyr][FSA]にLi塩を添加すると、室温で10-4 S cm-1を超えるイオン伝導度を示すこともわかり、[C2mpyr][FSA]を用いた全固体型Liイオン電池の開発も進めている29, 30。純粋な興味で取り組み始めたが、思わぬ成果を得ることができた。しかし、[C2mpyr][FSA]の柔粘性結晶相の温度範囲が広く、高イオン伝導性を示す理由については皆目見当がつかなかった。そこで、理解を深めるため系統的に構造を変化させることにした31-33。ピロリジニウム系柔粘性イオン結晶の構造を図5に示す。今回合成したピロリジニウム塩のカチオンとアニオンのイオン半径比(ρ)は0.73より大きく、CsCl型構造に帰属される。ρが物性の指標になるのではと考え、イオン伝導度との相関を調べた。図7に25℃におけるイオン伝導度とρの関係を示す33。[C2epyr][NFSA]を除き、ρの低下に伴いイオン伝導度が向上するという相関が得られた。徐々にではあるが理解は深まっており、構造と物性の相関について鋭意追跡中である。
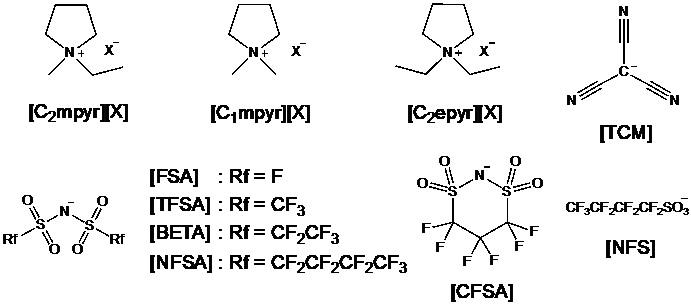
図5. ピロリジニウム系柔粘性イオン結晶の例

図6. [C2mpyr][FSA]の外観
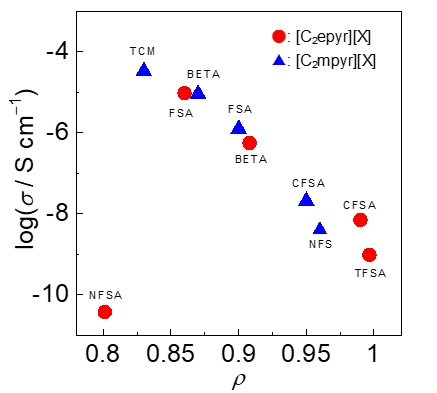
図7. 25℃におけるイオン伝導度とイオン半径比の関係
ある種のイオン液体は難溶性天然高分子であるセルロースを溶解すること、セルロースの溶解(水素結合の切断)にはアニオンのルイス塩基性(電子供与性)が重要であることが知られている34, 35。例えば、セルロース溶解能を有するイオン液体として、[C4mim]Cl36、 [C2mim][OAc]37、 [C2mim][(MeO)(H)PO2]38などが報告されている(図8)。これらイオン液体は、従来のセルロース溶剤に比べれば、温和な条件でセルロースを溶解できる。しかし、貧溶媒である水の存在下では、イオン液体といえどもセルロース溶解能が極端に低下する36, 39。水分を含むバイオマスの加工を考慮すれば、水存在下でセルロースを溶解できる溶剤も必要である。アニオンのルイス塩基性を向上させれば、目的のセルロース溶剤が得られるであろうことは想像できる。問題は、オニウムカチオンの耐塩基性が低いことである。アニオンの塩基性向上は、オニウム塩の分解(Hofmann分解)を促進する。実際、セルロース溶解能を有するイオン液体の熱分解温度は、電解質材料として使われているイオン液体と比べて、はるかに低い。耐塩基性に優れた構造として、ホスホニウム塩がOhnoらによって報告された40。TBPOH水溶液は強塩基性であるが、常温で保存してもTBPカチオンは分解されない。さらに、セルロースを溶解できる40。これにて一件落着。ではあるものの、今後、セルロースをバイオマテリアルとして応用する場合には、オニウム塩の毒性も重要な因子となると考えた。Vibrio fischeriやE. coli.を用いた評価において、ホスホニウム塩の毒性はアンモニウム塩やイミダゾリウム塩よりも高いとの報告もある41。アンモニウム塩系で、ホスホニウム塩の代替となる耐塩基性に優れた構造を探すことにしたが、記憶に留めておいた一つの論文がここで役立った。それは、[C1mpyr][OH]が四水和物で安定に存在し、水酸化物イオン伝導体となることを、MacFarlaneらが2001年に報告したものである42。論文を読んだ当時、水酸化物イオンを組み合わせても分解しないオニウムカチオンがあるのかと驚いた記憶があるため、ワーキングメモリしか持たない筆者の脳でも憶えていることができたのであろう。早速、[C4mpyr][OH]水溶液を作製し(図8)、セルロース溶解性を調べた43。水分量に応じてセルロース溶解性は変化するものの、[C4mpyr][OH]水溶液は25℃において最大20 wt%のセルロース(Avicel® CH-101)を溶解した(図9)43。TBPOH水溶液と同等の性能である。
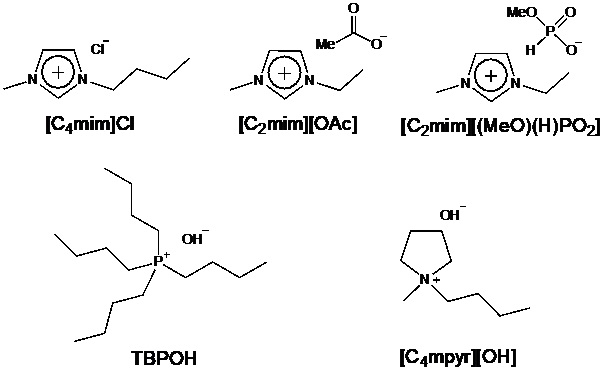
図8. セルロース溶剤の例
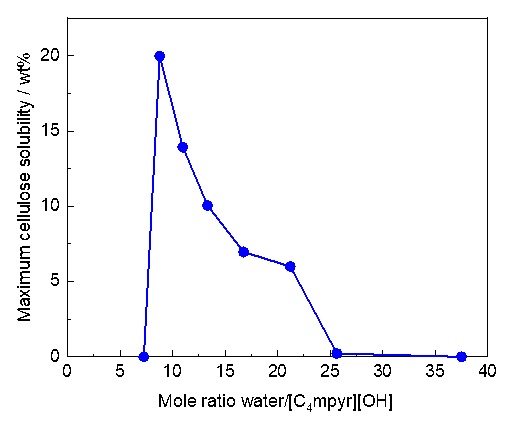
図9. [C4mpyr][OH]水溶液のセルロース溶解性
本稿では、ピロリジニウム塩に着目し、独断と偏見により、その魅力について述べた。筆者は、農工大において大野先生の指導の下、イオン液体(最初はPEO/塩ハイブリッド)の研究に取り組んだ。ポスドク時代は、Angell先生とMacFarlane先生に師事し、沢山の事を学んだ。本稿が師匠達へのオマージュとなり、筆者がピロリジニウム塩を好む理由が少しでも共有できたなら幸甚である。本来、無限とも思えるカチオンとアニオンの組み合わせの多彩さに魅力を感じて、新しいイオン構造の探索に時間を割いていた。そのような研究に対する興味は依然として持ち続けているが、現在は、臭いが便利なピロリジニウム塩に注力している。学生諸君の奮闘に心より感謝する。思いつきであるが、酒席などで各々お気に入りのオニウム塩や思い入れのあるオニウム塩について語り合うのも一興かもしれない(そう思うのは私だけ?)。新型コロナウィルス感染症(COVID-19)が落ち着いて欲しいと切に願う。さて、本稿を冷静に振り返ってみると、イオン液体研究会のサーキュラーで、イオン液体がほぼ出てこないではないかとお叱りを受けそうである。小心者の筆者は若干後悔している。さりとて、締め切りとの兼ね合いで書き直す時間もない。皆様の穏やかな笑顔と、COVID-19の一日でも早い収束を祈念して本稿を締めくくりたいと思う。
| 略号 | ||
|---|---|---|
| PEO | : poly(ethylene oxide) | |
| [C3mpyr][FSA] | : N-methyl-N-propylpyrrolidinium bis(fluorosulfonyl)amide | |
| [C1O2mpyr][FSA] | : N-methyl-N-methoxyethylpyrrolidinium bis(fluorosulfonyl)amide | |
| [C1O1mpyr][FSA] | : N-methyl-N-methoxymethylpyrrolidinium bis(fluorosulfonyl)amide | |
| LiTFSA | : lithium bis(trifluoromethylsulfonyl)amide | |
| C4pyrps | : 3-(1-butylpyrrolidinium)propane-1-sulfonate | |
| EO2pyrps | :3-(1-(2-(2-methoxyethoxy)ethyl) pyrrolidinium)propane-1-sulfonate |
|
| [C2mpyr][TFSA] | : N-ethyl-N-methylpyrrolidinium bis(trifluoromethylsulfonyl)amide | |
| [C2mpyr][FSA] | : N-ethyl-N-methylpyrrolidinium bis(fluorosulfonyl)amide | |
| [C2epyr][NFSA] | : N,N-diethylpyrrolidinium bis(1,1,2,2,3,3,4,4,4-nonafluoro-1-butylsulfonyl)amide | |
| [C4mim]Cl | : 1-butyl-3-methylimidazolium chloride | |
| [C2mim][OAc] | : 1-ethyl-3-methylimidazolium acetate | |
| [C2mim][(MeO)(H)PO2] | : 1-ethyl-3-methylimidazolium methylphosphonate | |
| TBPOH | : Tetrabutylphosphonium hydroxide | |
| [C1mpyr][OH] | : N,N-dimethylpyrrolidinium hydroxide | |
| [C4mpyr][OH] | : N-butyl-N-methylpyrrolidinium hydroxide | |
参考文献
- Armand, M.; Endres, F.; MacFarlane, D. R.; Ohno, H.; Scrosati, B., Nat. Mater. 2009, 8, 621-629.
- Tsuda, T.; Hussey, C. L., Electrochem. Soc. Interface 2007, 16, 42-49.
- Matsumoto, H.; Sakaebe, H.; Tatsumi, K.; Kikuta, M.; Ishiko, E.; Kono, M., J. Power Sources 2006, 160, 1308-1313.
- Ishikawa, M.; Sugimoto, T.; Kikuta, M.; Ishiko, E.; Kono, M., J. Power Sources 2006, 162, 658-662.
- Seki, S.; Kobayashi, Y.; Miyashiro, H.; Ohno, Y.; Mita, Y.; Terada, N.; Charest, P.; Guerfi, A.; Zaghib, K., J. Phys. Chem. C 2008, 112, 16708-16713.
- Zhou, Z.-B.; Matsumoto, H.; Tatsumi, K., Chem. Lett. 2004, 33, 1636-1637.
- Matsumoto, H.; Yanagida, M.; Tanimoto, K.; Nomura, M.; Kitagawa, Y.; Miyazaki, Y., Chem. Lett. 2000, 29, 922-923.
- Zhou, Z.-B.; Matsumoto, H.; Tatsumi, K., Chem. Lett. 2004, 33, 886-887.
- Appetecchi, G. B.; Montanino, M.; Carewska, M.; Moreno, M.; Alessandrini, F.; Passerini, S., Electrochim. Acta 2011, 56, 1300-1307.
- Reiter, J.; Paillard, E.; Grande, L.; Winter, M.; Passerini, S., Electrochim. Acta 2013, 91, 101-107.
- Horiuchi, S.; Yoshizawa-Fujita, M.; Takeoka, Y.; Rikukawa, M., J. Power Sources 2016, 325, 637-640.
- Zhou, Q.; Henderson, W. A.; Appetecchi, G. B.; Montanino, M.; Passerini, S., J. Phys. Chem. B 2008, 112, 13577-13580.
- Ohno, H.; Yoshizawa-Fujita, M.; Kohno, Y., Phys. Chem. Chem. Phys. 2018, 20, 10978-10991.
- Ohno, H.; Yoshizawa-Fujita, M.; Kohno, Y., Bull. Chem. Soc. Jpn. 2019, 92, 852-868.
- Yoshizawa, M.; Narita, A.; Ohno, H., Aust. J. Chem. 2004, 57, 139-144.
- Ohno, H., Bull. Chem. Soc. Jpn. 2006, 79, 1665-1680.
- Yoshizawa-Fujita, M.; Tamura, T.; Takeoka, Y.; Rikukawa, M., Chem. Commun. 2011, 47, 2345-2347.
- Suematsu, M.; Yoshizawa-Fujita, M.; Tamura, T.; Takeoka, Y.; Rikukawa, M., Int. J. Electrochem. Sci. 2015, 10, 248-258.
- Suematsu, M.; Yoshizawa-Fujita, M.; Zhu, H.; Forsyth, M.; Takeoka, Y.; Rikukawa, M., Electrochim. Acta 2015, 175, 209-213.
- Yamaguchi, S.; Yoshizawa-Fujita, M.; Zhu, H.; Forsyth, M.; Takeoka, Y.; Rikukawa, M., Electrochim. Acta 2015, 186, 471-477.
- Yamaguchi, S.; Yoshizawa-Fujita, M.; Takeoka, Y.; Rikukawa, M., J. Power Sources 2016, 331, 308-314.
- Horiuchi, S.; Zhu, H.; Forsyth, M.; Takeoka, Y.; Rikukawa, M.; Yoshizawa-Fujita, M., Electrochim. Acta 2017, 241, 272-280.
- MacFarlane, D. R.; Huang, J.; Forsyth, M., Nature 1999, 402, 792-794.
- Cooper, E. I.; Angell, C. A., Solid State Ionics 1986, 18-19, 570-576.
- Zhu, H.; MacFarlane, D. R.; Pringle, J. M.; Forsyth, M., Trends Chem. 2019, 1, 126-140.
- Pringle, J. M., Phys. Chem. Chem. Phys. 2013, 15, 1339-51.
- Yoshizawa-Fujita, M.; Kishi, E.; Suematsu, M.; Takekawa, T.; Rikukawa, M., Chem. Lett. 2014, 43, 1909-1911.
- Timmermans, J., J. Phys. Chem. Solids 1961, 18, 1-8.
- Wang, X.; Zhu, H.; Greene, G. W.; Zhou, Y.; Yoshizawa-Fujita, M.; Miyachi, Y.; Armand, M.; Forsyth, M.; Pringle, J. M.; Howlett, P. C., Adv. Mater. Technol. 2017, 2, 1700046.
- Zhou, Y.; Wang, X.; Zhu, H.; Yoshizawa-Fujita, M.; Miyachi, Y.; Armand, M.; Forsyth, M.; Greene, G. W.; Pringle, J. M.; Howlett, P. C., ChemSusChem 2017, 10, 3135-3145.
- Yamada, H.; Miyachi, Y.; Takeoka, Y.; Rikukawa, M.; Yoshizawa-Fujita, M., Electrochim. Acta 2019, 303, 293-298.
- Yamaguchi, S.; Yamada, H.; Takeoka, Y.; Rikukawa, M.; Yoshizawa-Fujita, M., New J. Chem. 2019, 43, 4008-4012.
- Yoshizawa-Fujita, M.; Yamada, H.; Yamaguchi, S.; Zhu, H.; Forsyth, M.; Takeoka, Y.; Rikukawa, M., Batteries & Supercaps 2020, 3, 884-891.
- Wang, H.; Gurau, G.; Rogers, R. D., Chem. Soc. Rev. 2012, 41, 1519-1537.
- Ohno, H.; Fukaya, Y., Chem. Lett. 2009, 38, 2-7.
- Swatloski, R. P.; Spear, S. K.; Holbrey, J. D.; Rogers, R. D., J. Am. Chem. Soc. 2002, 124, 4974-4975.
- Vitz, J.; Erdmenger, T.; Haensch, C.; Schubert, U. S., Green Chem. 2009, 11, 417-424.
- Fukaya, Y.; Hayashi, K.; Wada, M.; Ohno, H., Green Chem. 2008, 10, 44-46.
- Zhao, H.; Baker, G. A.; Song, Z.; Olubajo, O.; Crittle, T.; Peters, D., Green Chem. 2008, 10, 696-705.
- Abe, M.; Fukaya, Y.; Ohno, H., Chem. Commun. 2012, 48, 1808-1810.
- Oulego, P.; Blanco, D.; Ramos, D.; Viesca, J. L.; Díaz, M.; Hernández Battez, A., J. Mol. Liq. 2018, 272, 937-947.
- Sun, J.; MacFarlane, D. R.; Forsyth, M., J. Mater. Chem. 2001, 11, 2940-2942.
- Seiler, E. R. D.; Takeoka, Y.; Rikukawa, M.; Yoshizawa-Fujita, M., RSC Adv. 2020, 10, 11475-11480.
