Topics
2025.09.30 circular No.25
高濃度セルロース/イオン液体系における溶解と再生同志社大学 理工学部機能分子・生命化学科
遠藤 太佳嗣
植物の主成分であるセルロースが、イオン液体によく溶けるという発表が2002年になされてから1、様々なセルロース溶解能を持つイオン液体が開発されてきた。イオン液体へのセルロースの溶解メカニズムの理解も進む一方で、セルロース/イオン液体を用いたプロセスの社会実装への取り組みも盛んに行われている。
本稿では、セルロース/イオン液体の系において、我々のグループが2014年から進めてきた、(よく言えば)独走状態の領域である、高濃度セルロース/イオン液体の成果について紹介させていただきたい。2014年に、当時ポスドクをしていた金沢大学の高橋憲司先生の研究室でセルロースと初めて出会った。右も左も分からない状態だったが、関連論文を色々調べていく中で、セルロースが全く溶けないような高濃度でも、セルロース前処理(セルロースを溶解→再生し、セルロースの反応性を上げる処理)の効率が落ちないことが報告されていた2。高濃度でも前処理能が落ちないということは、この濃度領域において、分子・ナノレベルで何か不思議なことが起きているのではと考え、軽い気持ちでこのテーマをスタートさせた。
2.1.溶解
セルロースをイオン液体に溶解させていくと、イオン液体溶液の粘度は急激に上がっていき、そのうち、流動性のない固体になる(図1(a))。そのため、セルロース/イオン液体系の研究は流動性のある5–10 wt%程度で行われることが多い。なお、本稿では、wt%ではなく、mol%(グルコースユニットを1分子と考えたときのセルロースモル濃度)を使うが、用いたイオン液体とセルロースのグルコースユニットの分子量が近いために、wt%と読み替えてもさほど変わらない。
広角X線散乱法を用いて、種々の濃度のセルロース/イオン液体(1-ethyl-3-methylimidazolium acetate, [C2mim][OAc])混合物を測定した(図1(b))3。広角X線散乱では、結晶や液晶のような周期性のある構造がある場合に、シャープなピークが現れる。液体やガラスのような非晶性の物質でも、短距離では周期性が全くないわけではないので、中角領域でブロードなピークがでる。セルロースは結晶多形を示す物質だが、元々(天然)のセルロースは、I型と呼ばれる結晶形をとり、図1(b)下部(100 mol%)に示すようなパターンをとる。純粋なセルロース(100 mol%)から、イオン液体が加わりイオン液体濃度が高くなっていく(=セルロース濃度が低くなっていく、図1(b)下から上)と、セルロースの結晶構造由来のピークがどんどん消失していく。興味深いのは、セルロース濃度40 mol%程度でセルロースの結晶構造由来のピークはほとんどみえなくなり、広角X線散乱パターン上はほぼ完全な非晶質になるということである。
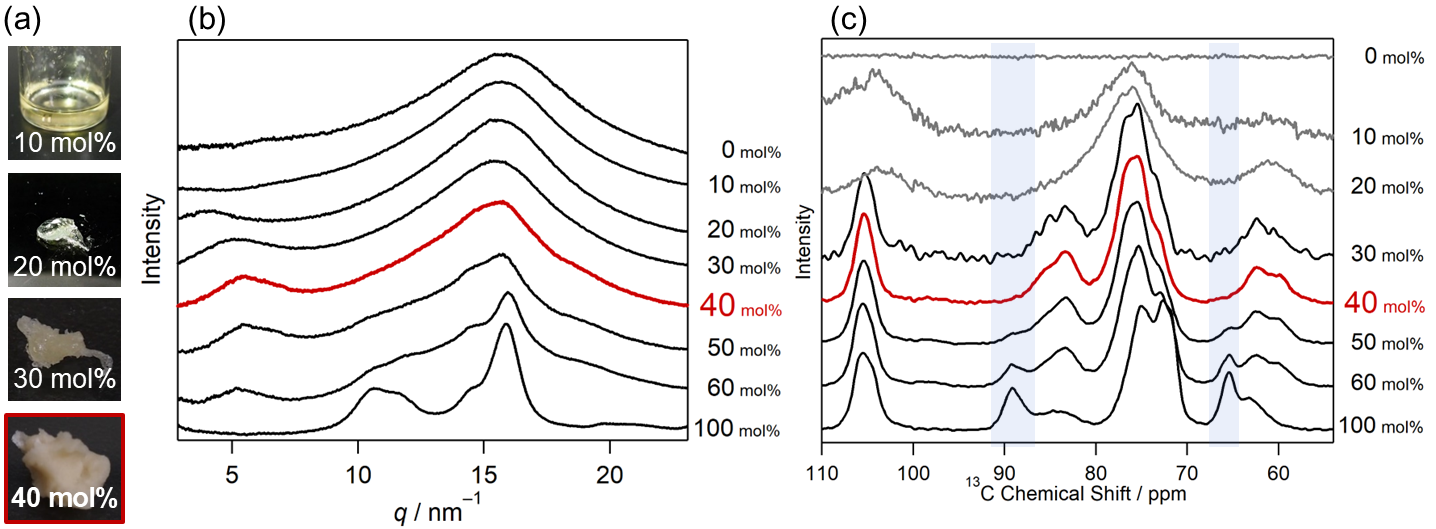
図1.セルロース/[C2mim][OAc]混合物の(a)写真、(b) 広角X線散乱パターン、(c)固体NMRスペクトル。
元々のセルロースのピークがそれほどシャープでないために、広角X線散乱パターンの結果だけでは、やや説得力に欠けると考え、固体NMRの測定も行った(図1(c))。固体NMRでは、セルロースの4位の炭素が、結晶状態(88–92 ppm)と非晶状態(80–88 ppm)で異なる化学シフトを持ち、ピークが割れることが知られている。また、6位の炭素のコンフォメーションも、結晶ではtrans-gaucheをとるが(65-68ppm)、非晶ではgauche-transとgauche-gauche(58-65 ppm)状態を主にとると認識
されている。
図1(c)が示す通り、固体NMRから見ても、40 mol%で、ほぼ完全な非晶状態となっていることが分かる。
しかし、最大40 mol%という溶解度は、当初は受け入れがたいものであった。というのも、セルロースのイオン液体への溶解メカニズムでは、イオン液体のアニオンが支配的な役割を果たしていることが当時すでに知られており、水素結合受容能の高いアニオンがセルロースの水酸基と水素結合を形成することで、セルロースの分子内・分子間の水素結合を破壊し、セルロースを溶解させていると考えられていた。このとき、実験・計算両面から、アニオンとセルロースのOH基は1:1での相互作用が主であることが示されていた4,5。グルコースユニットには3つの水酸基があることから考えると、1:1での相互作用では、25 mol%というのがセルロースの最大溶解度になる。セルロース/イオン液体の混合物を見ても20–30 mol%程度が透明で、溶解していると考えられる最大の濃度であるし、実際にこのイオン液体[C2mim][OAc]の実験的な最大溶解度は、28 mol%と報告されていた6,7。
即ち、最大の溶解度40 mol%というのは、イオン液体のアニオンが1:1の比率を超えて相互していることを示唆している。そこで、図2のようなモデルを立てた。即ち、低セルロース濃度では、確かに1:1が主であるが、濃度が上がるにつれ、1:多の相互作用に変化していく。このモデルは、簡単なモデル分子を用いた量子化学計算では支持された。また、最近、分子動力学計算でもそうなることを確かめている(in preparation)。
ここでしばしば疑問を投げかけられるのは、なぜほぼ完全にセルロースの結晶構造が存在しないのに、混合物は濁っているのか(図1(a))、ということである。当初は、粘度が高いため、マイクロサイズの気泡が入っていることが主因と考えていたが、おそらくより重要なのは、液晶相の存在であろう。セルロース/[C2mim][OAc]系は、10–20 mol%あたりから、液晶相が発現することが報告されており、実際に我々のグループも偏光顕微鏡で確認している。液晶相では、マイクロサイズの液晶ドメインが存在し、それが白濁の原因になり得ることが知られている。
液晶相を形成しているということは、液体やガラスのような完全な非晶質ではなく、ある程度構造を形成していることを意味している。実際広角X線散乱のパターンでは、15 mol%程度から小角領域にピークが現れている(図1(b))ことが、これに対応していると考えられる。なおこのピークは、35 mol%以上では位置は変わらず、その周期長は約1.2 nmと見積もられる。これは、セルロース-アニオンーセルロースの周期構造におおよそ一致しており(図2下)、このモデルが本当に正しいか、現在分子動力学計算で解析を進めている。
この高濃度領域でのもう一つ興味深いところは、30–50 mol%の混合物では、成形性が発現するというところである。これは、高濃度では、セルロース鎖同士が絡み合って物理架橋を形成していることを示唆している。実際、小角X線散乱測定をしてみると、10–20 nm程度の構造体が30 mol%より見えてくる8。
このように、高濃度(例えば40 mol%)では、元々のセルロースの結晶構造が破壊されている一方、液晶や物理架橋など、新たな構造体が形成していることが分かった。しかしこのような状態が、本当に「溶解している」といっていいのかについても、しばしば聞かれることがある。事実としては、40 mol%であっても、セルロースの元々の結晶構造は(ほぼ)存在しない、ということである。『理化学辞典』によると、溶解とは、「物質が溶媒に溶けて均一混合物となる現象」となる。セルロースの結晶構造が失われているということは、セルロースの水酸基の部分にはイオン液体(のアニオン)は、おおよそ均一に分布していると想像できる。非晶部分は結晶部分よりもイオンがアクセスしやすいから、ここにもおおよそイオン液体が均一に存在して、セルロースの水酸基と相互作用していると考えられる。このような意味では、「溶けている」と表現しても良いと思うが、どれだけ「均一」かについては、更なる研究が必要かもしれない。
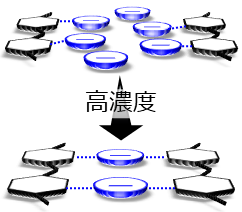
図2.セルロース/イオン液体の溶存状態のモデル
2.2. 再生
高濃度でのセルロース溶解(結晶構造破壊)現象の発見の次は、この基礎的知見をどう応用へ生かすかということが問題であった。既に述べた通り、高濃度セルロース/イオン液体では、セルロース前処理能が低下しないということが知られていたが、これらの結果は、セルロース単体ではなく、複雑なリグノセルロース(セルロース+ヘミセルロース+リグニン+α)の結果であった2。そこで、純粋なセルロースで、イオン液体の濃度を変えて前処理を行ってみた結果が図3である9。図3(a)は、イオン液体での前処理後、希硫酸でセルロースの酸加水分解を行い、グルコースへの反応速度定数(赤丸)を求めたものである。予想に反して、セルロース濃度を上げると、前処理効率が落ちないどころか、むしろ25 mol%までは増大するという結果であった。その後、反応速度定数は小さくなるが、50 mol%でさえ、5 mol%と同程度であった。5 mol%を基準に考えると、25 mol%では同じイオン液体量で6倍以上のセルロースが一度に処理できるにもかかわらず効率は1.6倍、50 mol%では効率は同程度で、20倍近いセルロースが一度に処理できることになる。
なぜ、濃度が高いと前処理能が上がるかは、セルロースの結晶化度(図3(b))から説明できる。セルロースを前処理すると、当初のI型から、反応性の高い非晶部分に加え、I型よりは反応性の高いII型にも部分的に変わることが知られている。図3(b)が示すように、25 mol%の方が、5 mol%よりも結晶化度が低かったのである。この現象は、粘度の違いで解釈できる。低濃度セルロースでは、高濃度の状態と比べて粘度が低く、水を加えた再生過程で、セルロース鎖同士が集まりやすい(並びやすい)。一方、高濃度では、セルロース鎖は非晶状態のままほとんど動けないために、結晶セルロースの量が少ない。ただ、40 mol%では、セルロースI型の結晶構造が残っている。これは、40 mol%では確かにI型の結晶はなくなり、アモルファスになってはいるが、配置的にはI型に近いアモルファスであり、再生と共に、反応性の低いI型にも少し戻っていることが原因であると考えられる。
これらの結果は、25 mol%を5 mol%と比べれば、一度に処理できるセルロースが増えるにもかかわらず、効率もあがるということで、正に一石二鳥の結果であった。同じ実験をリグノセルロースでやってみたところ、種類によっては、純粋なセルロースと同様の結果が得られることが分かった10,11。一方で難点は、セルロースのもう一つの糖化方法である酵素糖化では、このような現象が見られないということであった。酵素糖化では、セルロース濃度が低い方がより効率が高かった。これは、再生セルロースのアクセシビリティで説明できた。溶液でのセルロース濃度が上がると、結果として得られる再生セルロースが密につまり、酵素が入りにくくなる。酸はサイズが小さいためそれほど影響は受けないが、酵素はその大きなサイズのために、セルロース内部まで侵入できず、結晶化度が低くても、反応性が高くならないという結果になったと思われる。
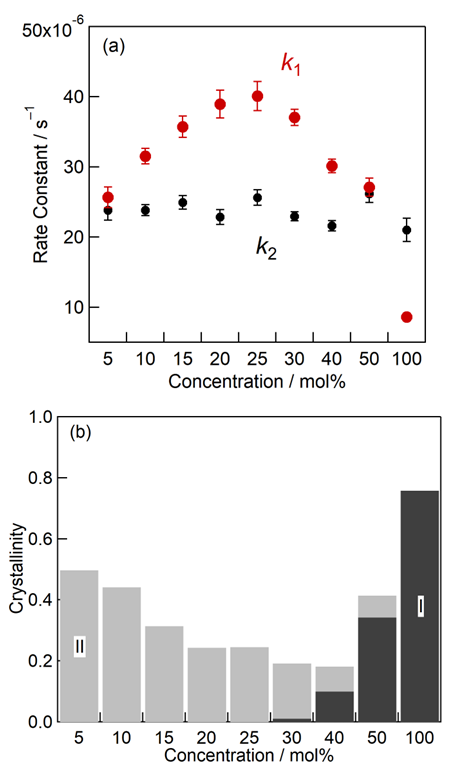
図3.[C2mim][OAc]で前処理したセルロースの(a)酸糖化反応速度(k1: セルロース→グルコス、k2:グルコース→分解物)と(b)結晶化度。
3.[C2mim][OAc]以外のイオン液体の高濃度溶解と再生3.1.溶解
これまでの結果は全て、イオン液体は[C2mim][OAc]しか使っていなかったが、その他のイオン液体(図4(a))ではどうなるのか試した結果が図4(b)–(d)である12,13。この図は広角X線散乱の結果であるが、比較しやすいよう、40 mol%の結果だけ載せてある。
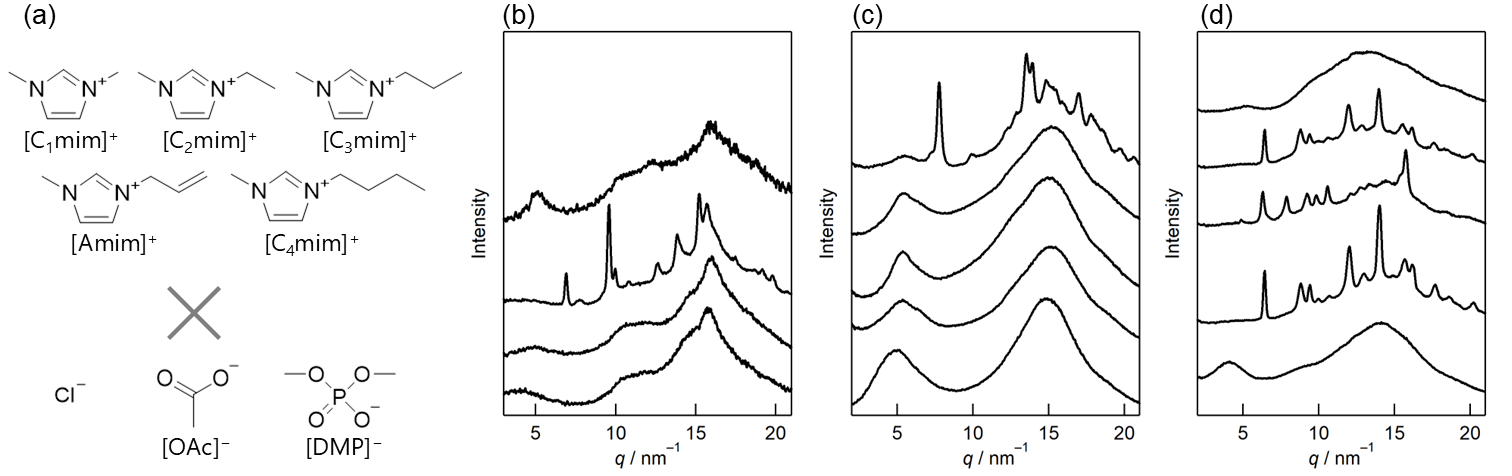
図4.(a) 用いたイオン液体のイオン構造。 (b) Cl系、(c) [OAc]系、(d) [DMP]系イオン液体とセルロース混合物の広角X線散乱パターン(40 mol%)。パターンは上から[C1mim]X, [C2mim]X、[C3mim]X、[Amim]X、[C4mim]X。なお、[C1mim]Clは融点が高かったためデータを示していない。13
この結果からいくつか興味深いことが分かる。まず、アニオンの違いを比べた場合、[OAc]系と[DMP]系、例えば[C4mim][OAc]と[C4mim][DMP]では、[C2mim][OAc]の結果と同様、セルロース結晶構造のほぼ完全な破壊が起きているが、Cl系(例えば[C4mim]Cl)では、40 mol%では、セルロース由来の構造が残ってしまっている。既に述べたように、セルロースの溶解には、アニオンの高い水素結合受容能が重要だが、この結果は、Cl−は、他の2つのアニオンと比べて、水素結合受容能が低い傾向にあるという実験事実と一致する。なお、[OAc]系、[DMP]系に限らず、Cl系であっても、[C2mim][OAc]で見られたセルロース-アニオン―セルロース由来と考えられる小角側のピークは見られている。
続いて、カチオン構造で比べると、側鎖の構造や長さは、セルロースの溶解性や構造性にはっきりとした違いはもたらしていないようである。アルキル鎖の長さが長くなると、イオン液体がセルロースの結晶構造内部に侵入しづらくなり、セルロース溶解度が落ちると考えられているが、methyl基からbutyl基の範囲では、少なくとも本系では、ほとんど差が見られていない。私は、実験的なセルロース溶解においては、粘度の効果も非常に大きく影響していると考えている。即ち、アルキル鎖が長くなると、粘度が大きくなる。それによって、セルロースの溶解速度が遅くなり、見かけの溶解度を低下させている可能性である。つまり、熱力学的な(例えば分子間相互作用のような)効果のみならず、速度論的な効果も、実験的な溶解度決定には大きな影響を与え得る。
このように、今回試した多くのイオン液体で、[C2mim][OAc]の時のように、高濃度でのセルロース溶解と自己組織化が起こっていると考えられる。一方で、いくつかのイオン液体([C3mim]Cl, [C1mim][OAc], [C2mim][DMP], [C3mim][DMP], [Amim][DMP])では、[C2mim][OAc]と異なり、高濃度セルロース/イオン液体で、シャープで特徴的なピークをいくつも示していることが図4(b)–(d)より分かる。これは、セルロースとイオン液体を混ぜると共結晶と呼ばれる新たな結晶相を形成していることを意味している。結晶相の形成濃度はおおよそ10–50 mol%であり、高濃度での特徴的な現象と言える。
3つのアニオン系を比べてみると、今回試した中では、Cl系、[OAc]系がただ一種類にもかかわらず、[DMP]系は3種類で共結晶が見られている。厳密には、[C1mim][DMP]もわずかながら共結晶が見られており、[DMP]系で共結晶を形成しやすいことが示唆される。[DMP]系の水素結合受容能は、[OAc]と同等か、やや低いと考えられているので、水素結合受容能では説明できない。一方、イオンサイズは他の2つよりも大きく、イミダゾリウムカチオンとおおよそ同程度である。このサイズによるパッキング効率の良さが、共結晶発現の重要な因子かもしれない。
セルロース/イオン液体系の共結晶は、[Amim]Clを使って、実は、2018年にSongらによって既に報告されていた14。しかしのちに彼らの結晶には水が含まれていることが分かった15。なお、彼らの共結晶の作り方はやや特殊で、温度と湿度を制御して結晶を作成していた。我々のグループでも何度か同等の条件でトライしたが、全てアモルファスになってしまい、共結晶を作ることは出来なかった。ただ、図4に示した結果は、セルロースもイオン液体も全て乾燥させて、露点の低い(−60℃以下)グローブボックス中で実験を行っており、セルロース/イオン液体の2元系の共結晶という意味では、我々の報告がおそらく初めてであると思う。なお、[C3mim]Clの共結晶では、水を含ませると結晶構造が僅かに変化し、加熱するとまた元に戻ることを確認している12。
このように高濃度で特徴的なセルロース/イオン液体共結晶において、一体どういった構造をとっているのかは、気になるところであった。結晶構造を決めるには、単結晶X線構造解析が最も直接的で強力だと思われるが、高分子であるセルロースを含んでいるため単結晶の作成が中々難しい。実際に学生に何度かトライしてもらったが、単結晶を得るまでには残念ながら至らなかった。広角X線散乱の測定・解析や固体NMRの結果から、セルロースの向きがおそらく反平行であることや、C6位のコンフォメーションでは、tgはとらないことなどが現時点で分かっていることだが、構造の詳細な解明には、更なる研究が必要となる。
3.2.再生
高濃度でのセルロース/イオン液体共結晶の発現は、現象としては興味深いが、これが何かに使えれば、よりインパクトがある。そこで、[C2mim][OAc]の時と同様、まずは共結晶状態からの再生を試みた。結果としては、共結晶を経由すると、得られた再生セルロースII型の結晶化度が、共結晶を作らないものよりもわずかに大きいという結果が出た13。これは、上で述べたように、共結晶中のセルロース鎖が反平行になっていることが原因と考えられる。しかしながら、両者にそこまで大きな違いはなかった。
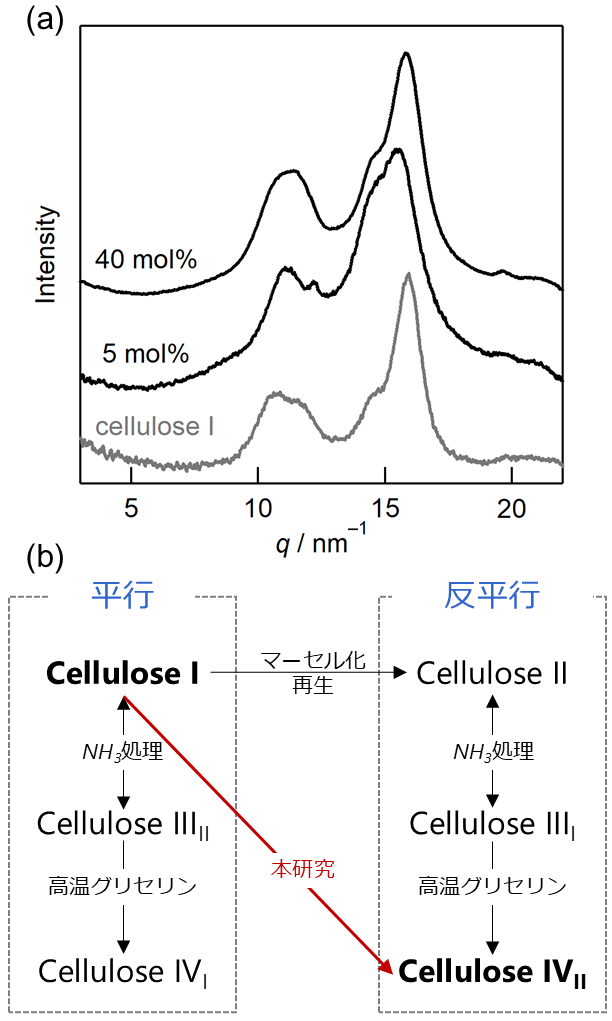
図5.(a) [C1mim][DMP]を用いた再生セルロースの広角X線散乱パターン。(b) セルロースの結晶多形と転移。
共結晶からのセルロース再生を、実験条件を変えながら種々試していく中で、不思議な結果が得られることがあった。通常、天然セルロースはI型で、一度溶解させると熱力学的に安定なII型に変化するのは、上で述べた通りである。しかし、あるイオン液体のある再生条件では、II型に転移せず、I型に戻るようなパターンが得られた(図5(a))。検討・解析を進めていく中で、これはI型ではなく、セルロースIVII型であることが分かった16。
セルロースの結晶形はI型(Iα, Iβ)、II型の他に、全部で7種の結晶形が知られているが(図5(b))、天然のI型からII型以外に転移させるのは、通常多段階のプロセスが必要となる。特にIVII型は、よく知られているやり方では煩雑で、かつ、かなりの高温(例えば260℃)が必要である。近年Caoらによって、室温でのI型からIVII型への転移方法が報告された17が、10時間程度のエージングが必要な上に、II型が一部混ざる。今回我々が発見した方法、具体的にはイミダゾリウムカチオン[DMP]系で、5 mol%、100℃の水で再生させることで、結晶化度は30%程度と高くないものの、ほぼ完全なIVII型に転移させられる。イオン液体を用いて、II型以外を作成したのも初めてであろうし、おそらくIVII型の作成方法の中ではもっとも簡便な方法である。
一方で、なぜこの条件でIVII型が出来るのかはまだよく分かっていない。IVII型の結晶は、高温安定型と言われており、100℃が必要なのは、IVII型の熱力学的な安定性と関係しているのであろう。IVII型の議論を難しくしているのは、数あるセルロース結晶多形の中で、この結晶形の結晶構造がまだ決められていない点である。また、IVII型が割合容易に調整できるといっても、では一体この結晶形が何に使えるのかもはっきりしない。現状、今後の進展を待たなければならない。
最後に
高濃度セルロース/イオン液体に関連した我々のグループの成果を中心に紹介させていただいた。なお、本稿は、2022年に書かせていただいた解説記事18にアップデートを加えたものであり、重複する部分があることをご容赦願いたい。高濃度セルロースでは、その溶解現象や構造化、更に再生における特異性など、様々な興味深い現象が観察されている。一方で、そのメカニズム解明や、例えばカチオン構造の依存性など、伸びしろはまだまだあると考えている。今後の更なる研究の進展を私自身も期待して、本稿を閉じたい。
参考文献
- R. P. Swatloski, S. K. Spear, J. D. Holbrey, R. D. Rogers, J. Am. Chem. Soc. 2002, 124, 4974-4975.
- K. Ninomiya, H. Soda, C. Ogino, K. Takahashi, N. Shimizu, Bioresour. Technol. 2013, 128, 188-192.
- T. Endo, S. Hosomi, S. Fujii, K. Ninomiya, K. Takahashi, J. Phys. Chem. Lett. 2016, 7, 5156-5161.
- R. C. Remsing, R. P. Swatloski, R. D. Rogers, G. Moyna, Chem. Commun. 2006, 1271-1273.
- B. D. Rabideau, A. E. Ismail, Phys. Chem. Chem. Phys. 2015, 17, 5767-5775.
- K. A. Le, C. Rudaz, T. Budtova, Carbohydr. Polym. 2014, 105, 237-243.
- D. M. Rein, R. Khalfin, N. Szekely, Y. Cohen, Carbohydr. Polym. 2014, 112, 125-133.
- T. Endo, S. Hosomi, S. Fujii, K. Takahashi, K. Ninomiya, Molecules 2017, 22.
- T. Endo, E. M. Aung, S. Fujii, S. Hosomi, M. Kimizu, K. Ninomiya, K. Takahashi, Carbohydr. Polym. 2017, 176, 365-373.
- E. M. Aung, T. Endo, S. Fujii, K. Kuroda, K. Ninomiya, K. Takahashi, Ind. Crops Prod. 2018, 119, 243-248.
- T. Endo, S. Fujii, E. M. Aung, K. Kuroda, T. Tsukegi, K. Ninomiya, K. Takahashi, BioResources 2019, 13, 6663-6677.
- T. Endo, S. Yoshida, Y. Kimura, Cryst. Growth Des. 2020, 20, 6267-6271.
- T. Endo, T. Nakano, N. Tokumasu, Y. Kimura, Cryst. Growth Des. 2022, 22, 7603-7610.
- G. Song, J. Yu, M. Ding, J. Zhang, Cryst. Growth Des. 2018, 18, 4260-4264.
- G. Song, J. Zhang, Y. Nishiyama, Cellulose 2020, 27, 5449-5455.
- N. Tokumasu, T. Nakano, S. Yoshida, Y. Kimura, T. Endo, CrystEngComm 2024, 26, 5777-5784.
- J. Cao, W. Wei, G. Gou, M. Jiang, Y. Cui, S. Zhang, Y. Wang, Z. Zhou, Cellulose 2018, 25, 1975-1986.
- 遠藤太佳嗣, Cellulose communications 2022, 29, 151-157.
